A molécula de água é considerada um dipolo elétrico porque a ligação entre os átomos de hidrogênio e oxigênio forma polos negativos e positivos. Isso acontece porque a ligação entre os dois elementos (H e O) é polar, devido a grande diferença de eletronegatividade entre os seus átomos.
Por causa disso, o compartilhamento de elétrons é desproporcional, já que os polos negativos atraem o oxigênio (elemento com mais força), enquanto o polo positivo atrai o hidrogênio (elemento com menos força).
Quanto à polaridade da molécula da água, que é polar, podemos dizer que a configuração de sua nuvem eletrônica (elétrons que ficam em torno da molécula) é desigual, já que o oxigênio atrai a maioria dos elétrons por ser mais eletronegativo que os átomos de hidrogênio.
O que é um Dipolo Elétrico?
Um dipolo elétrico é o conjunto de duas cargas com módulos iguais (mesmo valor) mas com sinais opostos, separadas por uma certa distância.
As moléculas são consideradas dipolos quando há a separação das cargas elétricas devido à distribuição desproporcional dos elétrons em torno dos átomos, que é provocada pelas diferenças de eletronegatividade entre os elétrons, como no caso da molécula de água.
Por que os Sais Podem ser Dissolvidos em Água?
Os sais podem ser dissolvidos em água porque as moléculas de água presentes em maior quantidade cercam todos os íons da molécula do sal. Quando um pouco de sal de cozinha (NaCl), por exemplo, é colocado em um copo com água, o lado negativo da molécula de sal atrai o lado positivo das moléculas de água e vice-versa, fazendo, assim, a dissolução do sal. No entanto, nem todos os sais existentes podem ser dissolvidos em água.
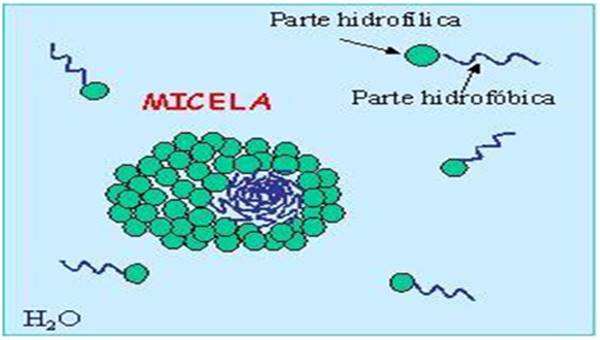
Formação de Micelas em uma Solução de Água + Soluto Apolar
As micelas são formadas em uma solução de água + soluto apolar porque as soluções apolares não possuem afinidade com a água (hidrofóbicas).
Como exemplo, temos a água e óleo, que não se misturam porque o óleo possui uma cadeia de hidrocarbonetos apolar e um grupo carboxil polar em sua extremidade. Enquanto o grupo Carboxil interage com a água, a cadeia de hidrocarbonetos não interage, formando as micelas.
Por Que Água e Óleo não se Misturam?
A água e o óleo não se misturam porque as moléculas de água possuem ligações polares, enquanto o óleo possui ligações apolares, então eles não se atraem. O óleo também é uma substância hidrofóbica, ou seja, repele a água. O óleo flutua sobre a água porque sua densidade é menor que a da água.
Atualizado em: 27/05/2018 na categoria: Água